Forschungsschwerpunkte
Meine Gruppe interessiert sich für die Aufklärung von Signalwegen, die die Funktion von Immunzellen bei der Alterung und bei neurodegenerativen Erkrankungen regulieren, mit einem besonderen Schwerpunkt auf myeloide Zellen, den Komponenten des angeborenen Immunsystems.
Insbesondere sind wir daran interessiert, die Veränderungen zu verstehen, die Immunzellen wie Mikroglia und Neutrophile mit dem Alter und bei der Alzheimer-Krankheit charakterisieren, um neue Signalwege und molekulare Ziele zu identifizieren, die zu therapeutischen Interventionen führen können.
Signalwege zur Regulierung von Entzündungen in gealterten Mikroglia
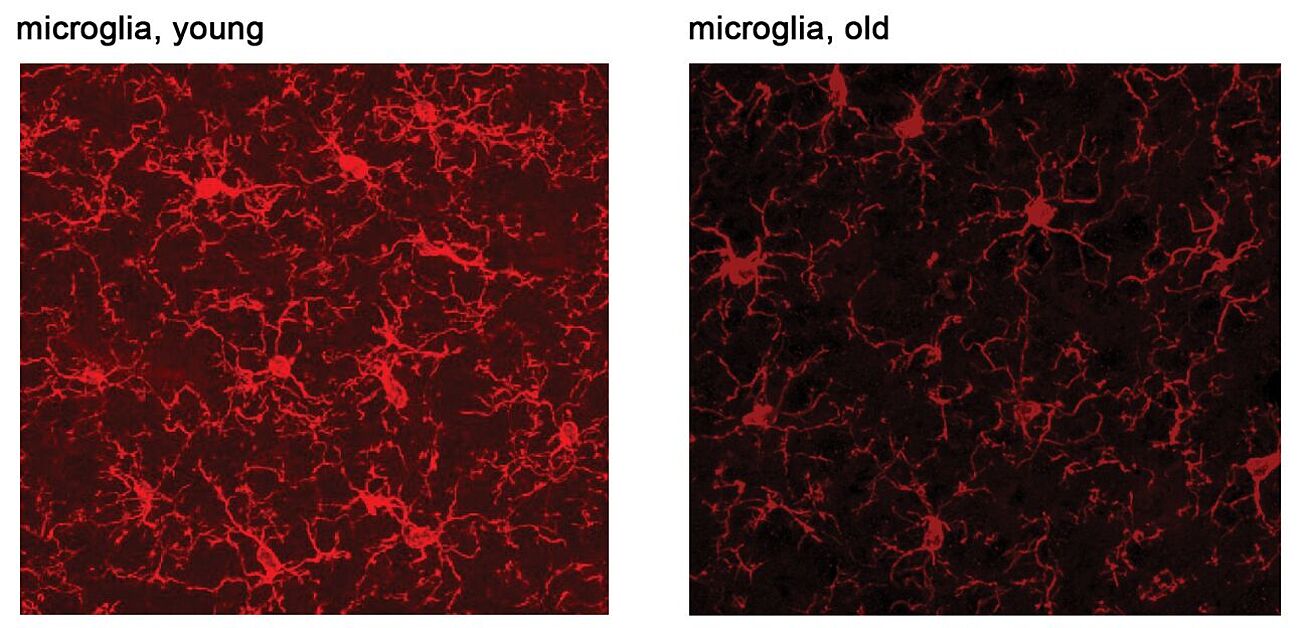
Mikroglia sind die Immunzellen des Gehirns. Sie spielen eine wichtige Rolle in der neuronalen Zellhomöostase, können aber bei neurodegenerativen Erkrankungen durch die Produktion von Entzündungsfaktoren zur Krankheitspathologie beitragen. Es wird zunehmend anerkannt, dass Mikroglia mit dem Alter zunehmend beeinträchtigt werden (Abbildung 1). Es muss jedoch noch weiter geklärt werden, welche Mikroglia-Funktionen und in welchem zeitlichen Stadium Resilienz oder Anfälligkeit gegenüber biologischen Schädigungen im Zusammenhang mit dem Altern verleihen, sowie ihre Beziehung zur Neurodegeneration (reviewed in Antignano et al., CMLS, 2023). Nichtsdestotrotz sind übermäßige Entzündungsreaktionen in Form von Zytokinproduktion allgemein bekannte schädliche Ereignisse, die sich nachteilig auf die neuronale Gesundheit auswirken können. Bei der Untersuchung von Veränderungen in den Signalwegen, die Entzündungsreaktionen in gealterten Mikroglia regulieren, entdeckten wir eine Hochregulierung des mTORC1-Signalwegs, insbesondere in seiner Regulation der Proteinsynthese.
Im Verlauf einer Entzündungsreaktion synthetisieren gealterte Mikroglia tatsächlich größere Mengen an Entzündungsmediatoren wie Zytokine und Immunrezeptoren (Keane*, Antignano* et al., JCI, 2021; Antignano et al., STAR Protocols, 2023). Die genetische Hemmung der mTORC1-Signalübertragung führte zu einem Rückgang der Entzündung, da weniger Proteinmediatoren vorhanden waren, obwohl ihre mRNA-Expressionswerte höher waren. Überraschenderweise schien die Hemmung von mTORC1 eine eher spezifische Wirkung auf die Translation der Entzündungsreaktion zu haben, obwohl es insgesamt eine Rolle bei der mRNA-Translation spielt, indem es verschiedene Schritte der ribosomalen Biogenese, der Translationsinitiierung und -verlängerung reguliert. Um die Auswirkungen einer Beeinträchtigung von mTORC1 in Mikroglia bei der Alterung vollständig zu verstehen, erforschen wir nun die Spezifität der mTORC1-Regulierung über das Mikroglia-Translatom sowie die Wege, die zu einer mTORC1-Hochregulierung führen (durch das von der EU finanzierte DN-MSCA Eternity), und allgemeiner die Veränderungen der Translationsregulierung in gealterten Mikroglia.
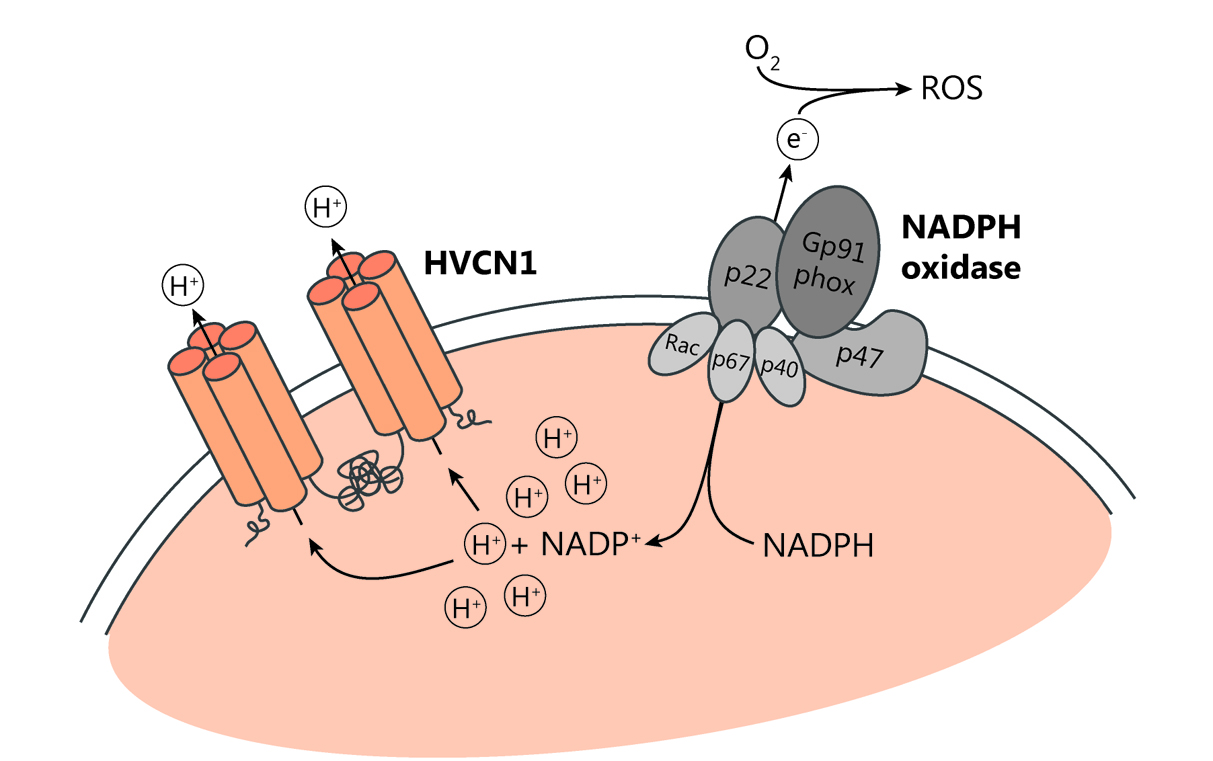
Untersuchung von Protonenkanälen zur Identifizierung potenzieller neuer Angriffspunkte bei der Alzheimer-Krankheit
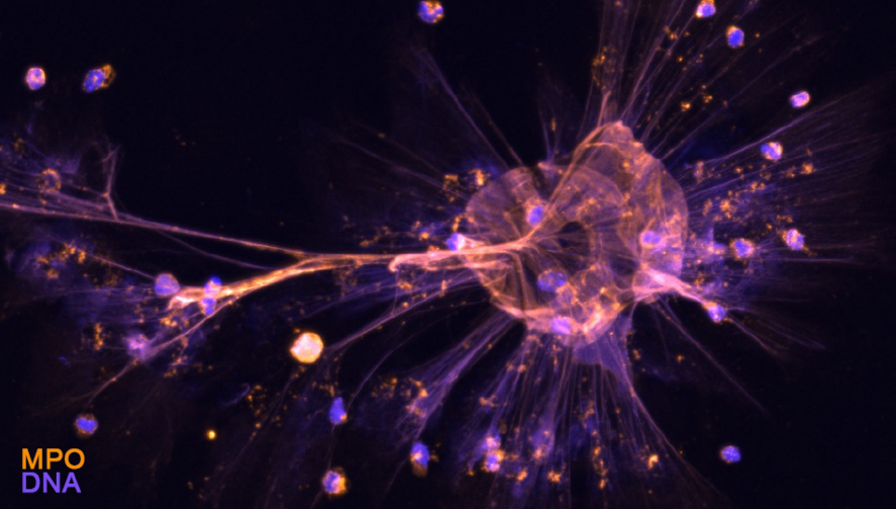
Unser Labor ist seit langem an Protonenkanälen interessiert, von denen wir herausgefunden haben, dass sie die Reaktion von B- und T-Zellen sowie die Funktionen von Neutrophilen regulieren (Coe et al., JCI Insight, 2022; Hondares et al., PNAS, 2014; Capasso et al., Nat Immunol, 2010; Morgan et al., PNAS, 2009). Es gibt nur einen spannungsabhängigen Protonenkanal bei Säugetieren, HVCN1, dessen Funktion darin besteht, die intrazelluläre Übersäuerung und die Depolarisierung der Membran zu verringern, indem er Protonen entlang ihres chemischen Gradienten aus der Zelle herauslässt. Auf diese Weise hält er die Produktion reaktiver Sauerstoffspezies (ROS) durch das Enzym NADPH-Oxidase aufrecht (Abbildung 2). In myeloischen Zellen hält HVCN1 auch die Aktivität der NADPH-Oxidase aufrecht, jedoch ist seine Rolle in Zellen, die in die Pathogenese der Alzheimer-Krankheit involviert sind, wie Mikroglia und Neutrophile (Abbildung 3), noch nicht geklärt. Protonenkanäle scheinen Zellfunktionen zu regulieren, die nicht direkt mit der NADPH-Oxidase-ROS-Produktion verbunden sind. Wir kombinieren In-vivo- und In-vitro-Studien, um die Auswirkungen des HVCN1-Verlusts auf die Funktion dieser Zellen im Dauerzustand und im Zusammenhang mit der Alzheimer-Krankheit zu klären.