Forschungsschwerpunkte
Proteine sind die „Arbeitstiere“ der Zellen und ermöglichen nahezu alle zellulären Funktionen, von der Genomorganisation über Signalkaskaden bis hin zur mechanischen Unterstützung von Zellstrukturen und dem Transport von Molekülen. Neuronen sind besonders inhomogene, nicht-teilende Zellen mit extrem langen Fortsätzen und verschiedenen Mikroumgebungen, welche eine robuste Regulierung der hochspezialisierten Proteinprozesse und -funktionen in den verschiedenen Kompartimenten und Situationen verlangen. In neurodegenerativen Erkrankungen und während des Alterns können sich Proteinwirkungen ändern, und häufig kommt es zu Funktionsverlust, Fehlfunktionen und Aggregation von Proteinen.
In unserer Arbeitsgruppe verwenden wir ein breites Spektrum experimenteller Methoden und Techniken – von biophysikalische und biochemische Techniken, über Zellkultur und Tiermodelle, hin zu postmortalem human Gewebe -, um die Wirkungen von Proteinen während ihrer normalen Funktion und Fehlfunktion im erkrankten Gehirn zu zu verstehen. Dabei fokussieren wir uns derzeit auf das intrinsisch ungefaltete neuronale Mikrotubuli-assoziierte Tau-Protein, welches in mehreren neurodegenerativen Erkrankungen aggregiert. Desweiteren scheint tau eine Vielzahl weiterer Funktionen in der Zelle zu haben.
Durch die Identifizierung „ungewöhnlicher“ Funktionen von Tau (und anderen Proteinen) im Gehirn, versuchen wir neue therapeutischer Ansätze zu entwickeln.
An den folgenden Forschungsfeldern wird momentan in unserer Gruppe gearbeitet:
1. (Patho)Physiologische Aktivatoren von Tau im Gehirn
Das Mikrotubuli-assoziierte Protein Tau (MAPT ist in Neuronen des Zentralnervensystems reichlich vorhanden, wo es unter gesunden Bedingungen vermutlich hauptsächlich in Axonen lokalisiert ist. In verschiedenen neurologischen Erkrankungen wird Tau „aktiviert“, was zu dessen erhöhter Tau Phosphorylierung und Akkumulation im somato-dendritischen Kompartment von Nervenzellen führt. Der Grund für diese „Umsortierung“ ist nicht bekannt. Bei Krankheitszuständen, wie z.B., der Alzheimer-Krankheit und primären Tauopathien, stellt die Ansammlung von hochphosphoryliertem Tau in neuronalen Zellkörpern ein pathologisches Kennzeichen dar, welches mit neuronalem Tod und kognitivem Verfall korreliert. Phosphorylierung und somatodendritische Umlagerung von Tau werden daher oft als propathologische Ereignisse interpretiert. In unserer Gruppe untersuchen wir, welche physiologischen Bedingungen die Tau-Aktivierung auslösen können und versuchen, das „Wie“ und „Wozu“ dieser Aktivierung zu beantworten. Um die Wirkungen von Tau und ihre Auslöser zu verstehen, untersuchen wir Situationsabhängige Wechselwirkungen von Tau mit anderen Proteinen und RNA. Wir verwenden Zell- und Tiermodelle einer durch Autoimmunantikörper induzierten Tauopathie, der IgLON5-Krankheit, was es uns ermöglicht, die Mechanismen, die zur Tau-Aktivierung im Gehirn führen aus einem einzigartigen Blickwinkelzu untersuchen.
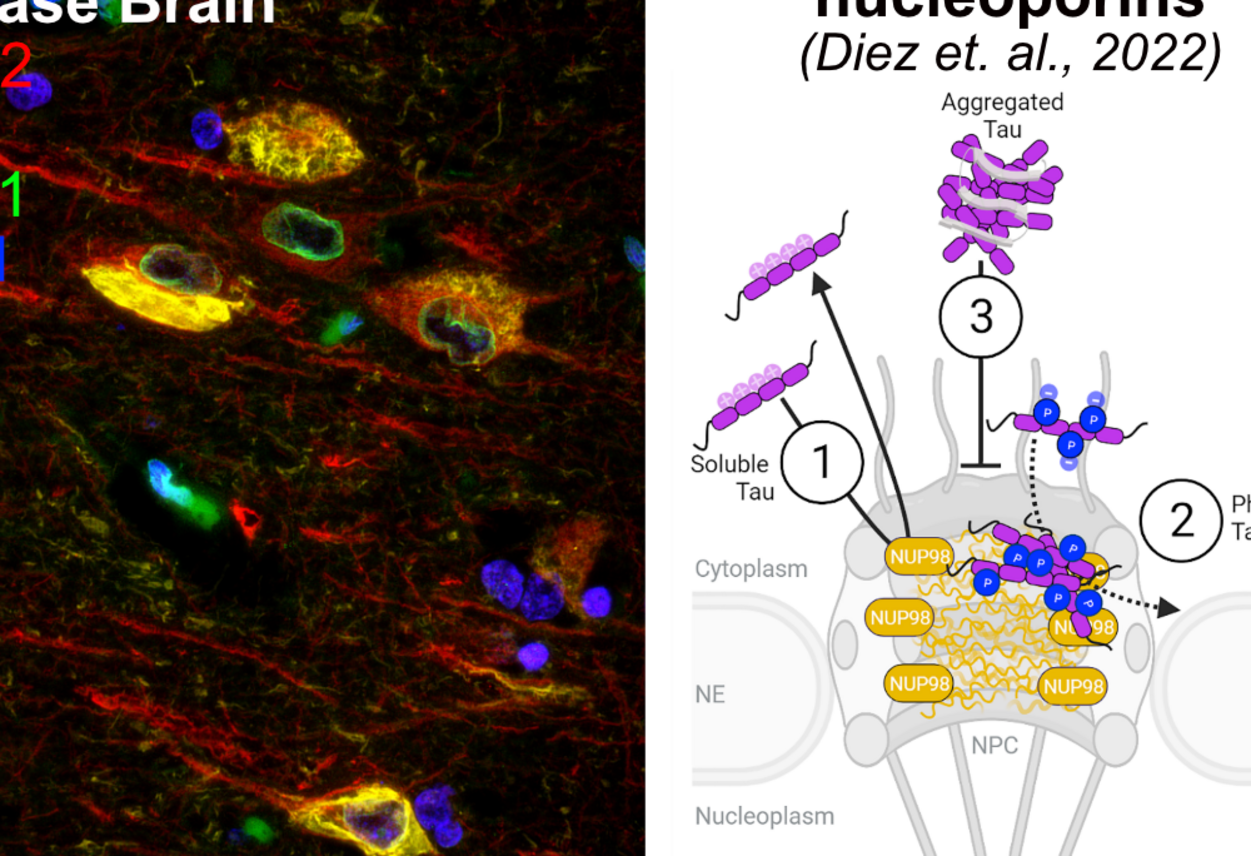
2. Neuartige und ungewöhnliche Funktionen des Mikrotubuli-assoziierten Proteins Tau
Anhand der Resultate von zahlreichen Publikationen der letzten Jahre scheint es, dass Tau an einer Reihe zellulärer Prozesse beteiligt ist, welche vermutlich unabhängig von seiner ausgeprägten Bindung an axonale Mikrotubuli sind. In unserer Arbeitsgruppe sind wir besonders an den Interaktionen interessiert, die Tau bei seiner „Aktivierung“ (durch Phosphorylierung und somatodendritisches Auftreten) erwirbt. Diese Wechselwirkungen von Tau könnten Teil der physiologischen neuronalen Stressantwort darstellen, welche erst auf lange Sicht zu pathologischen Veränderungen in der neuronalen Physiologie und zu Neurotoxizität und Proteinaggregation führen würden. Derzeit konzentrieren wir uns auf die Wechselwirkungen von Tau mit dem neuronalen Zellkern, da Phospho-Tau diesem essentiellen Organell sowohl bei der normalen neuronalen Stressreaktion als auch im Frühstadium der Alzhheimer Krankheit „begegnet“. Spezifisch befassen sich unsere Studien mit der Interaktion zwischen Tau und nukleo-zytoplasmatischen Transporteffektoren (z. B. Kernporen und Kerntransportfaktoren) sowie deren Konsequenzen für die neuronale Chromatinorganisation und Genexpression.
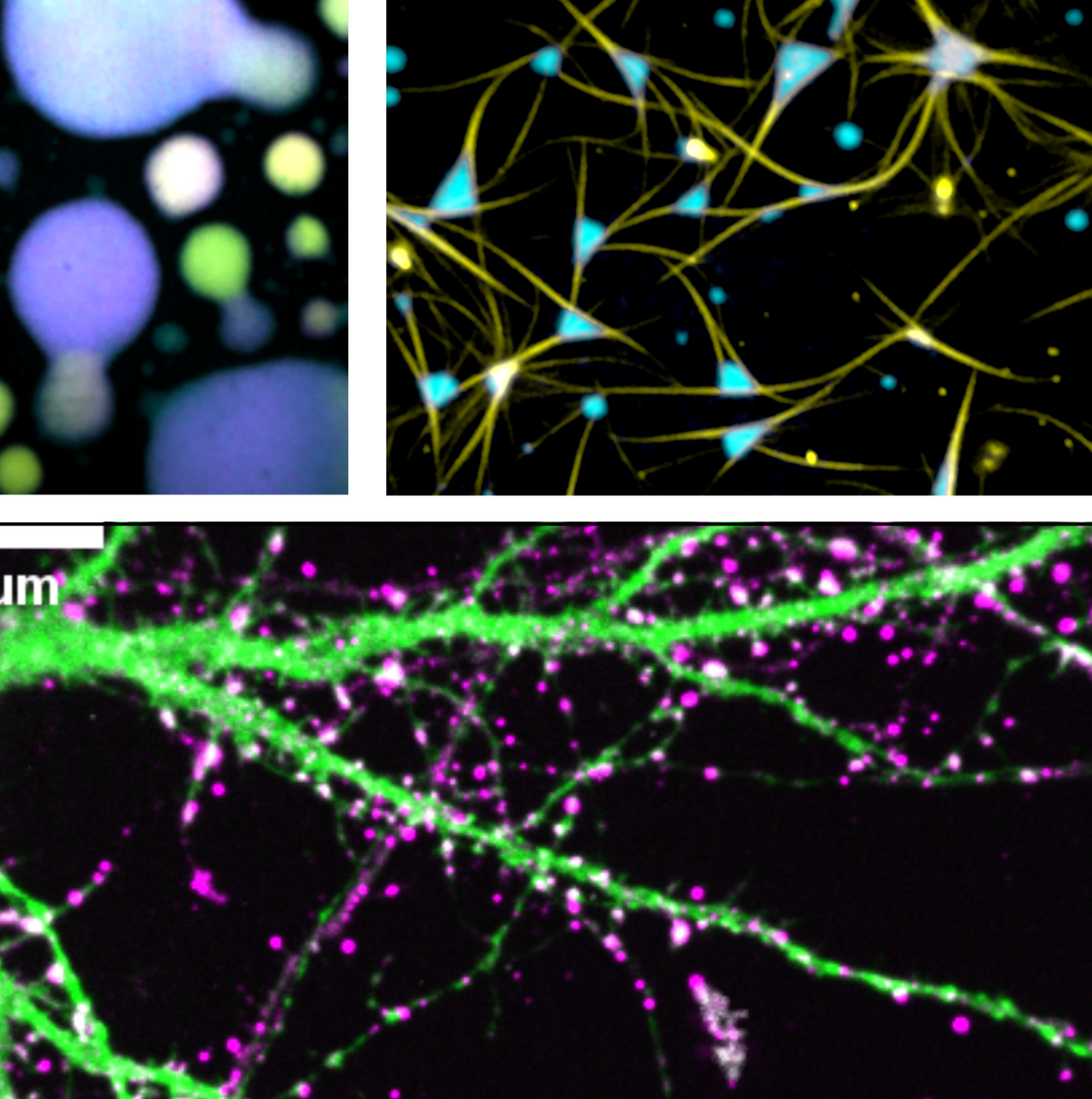
3. Biologie von kondensierten Tau Phasen
Tau hat die Fähigkeit, in verschiedene, multimeren Zuständen zu assemblieren, z.B. in physiologische Dimere, kleine lösliche Oligomere, fibrilläre Aggregate mit viel Beta-Struktur und flüssigkeitsähnliche Kondensate. Unser besonderes Interesse gilt den Eigenschaften und dem einzigartigen biologischen Potenzial kondensierter Tau Phasen. Dieser Anordnungszustand kann nicht nur pathologische Tau-Aggregation induzieren, sondern bietet uns auch Raum für die Neuinterpretation früherer (teils kontroverser) Erkenntnisse zu Tau-Fehlfunktionen. Unsere Erkenntnisse an Tau Flüssigphasen fördern das Verständnis dafür, wie Tau verschiedene zelluläre Prozesse beeinflussen kann, aber auch wie tau selbst von Nervenzellen für den größten Teil des Lebens unter Kontrolle gehalten werden kann.











